¿QUE ES LA ENERGÍA DE ACTIVACIÓN?
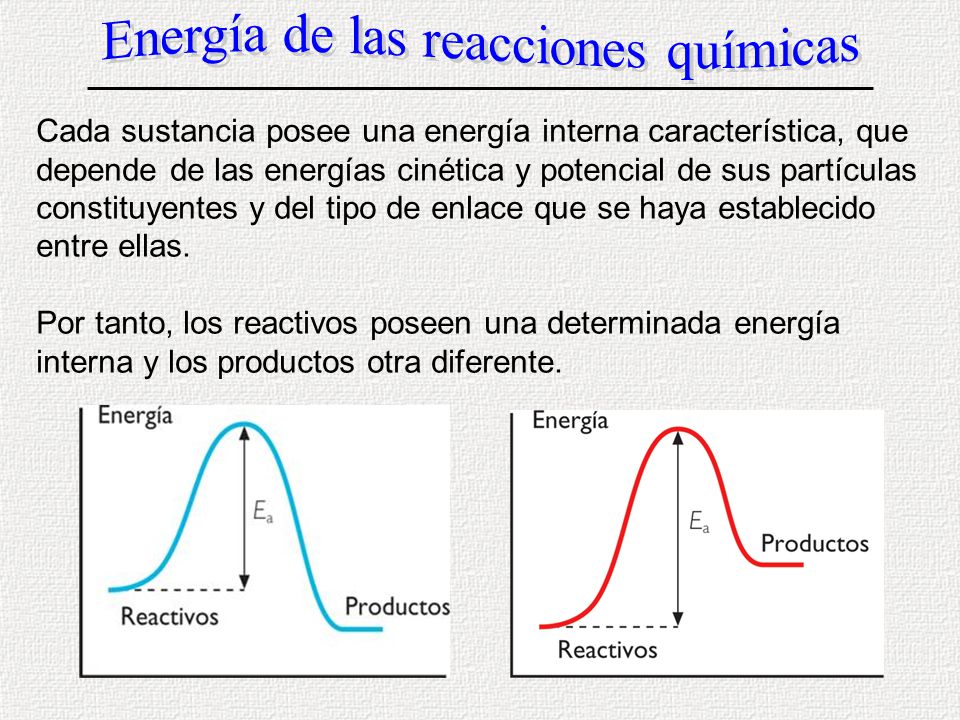
En la química la energía de activación , es la energía que debe absorber los reactivos en sus estados fundamentales para alcanzar el estado de transición
en otras palabras , si los reactivos a y b no se poseen la suficiente energía de activación es entonces , la energía mínima necesaria para que se produzca una reacción química dada para que ocurra una reacción entre dos moléculas
estas devén colisionar en la orientación correcta y poseer una cantidad de energía minina
¿que es la energia en las reacciones quimicas?
El estudio de las reacciones químicas desde un punto de vista energético mejora la descripción de los procesos químicos. La entalpía o contenido energético cambia al pasar de los reactivos a los productos y, junto con la entropía o grado de desorden, determina el que una reacción se produzca o no espontáneamente. La vcción química no depende del camino seguido por la reacción, sino sólo de los estados inicial y final.ariación de entalpía en una rea
Las reacciones químicas son procesos de transformación o cambio de unas sustancias en otras. En ciertas ocasiones, el interés de este tipo de procesos se centra en la obtención de nuevos productos útiles para la medicina o para la industria; en otras, se persigue la obtención de energía; tal es el caso, por ejemplo, de la combustión de la gasolina o del carbón. En general, las reacciones químicas llevan consigo cambios materiales y también cambios energéticos.
El estudio de los procesos químicos requiere,por tanto, algo más que cálculos sobre cuánta cantidad de productos se forma a partir de una cantidad dada de reactivos. La determinación de la cantidad de energía puesta en juego en una reacción o la explicación de su carácter espontáneo constituyen algunas de las cuestiones o aspectos energéticos de las reacciones químicas.
FORMULAS
Ea ¡ : energía de activación inversa
E a d : energía de activación directa

No hay comentarios.:
Publicar un comentario